Depois do caos criador, tudo no universo está em busca de um pouco de equilíbrio. Em um nível atômico, essa estabilidade pode ser obtida através da doação ou compartilhamento de elétrons formando as ligações químicas.
Essas interações fundamentais unem os elementos e moldam suas propriedades, resultando nas diversas substâncias, líquidas, sólidas ou gasosas, que conhecemos no cosmos. Mas elas não iguais.
Hoje nós vamos relembrar o motivo pelo qual química era sua matéria preferida na escola, e se você for vestibulando, fique ligado nas diferenças!

Todos querem ser nobres!
A anatomia simples de um átomo revela um núcleo circundado por uma eletrosfera. Enquanto o conteúdo nuclear contém prótons e nêutrons, a eletrosfera é formada por elétrons em diferentes camadas de energia.
Essas camadas podem ser mais ou menos estáveis, a depender da quantidade de elétrons que ela suporta ou que necessita para se manter. Geralmente, os elementos respondem a uma “lei” chamada de Regra do Octeto, onde a grande maioria dos elementos precisa de ao menos oito elétrons em sua última camada de valência para se manterem estabilizados.

Porém, sempre há os filhos rebeldes da Tabela Periódica como o Berílio, Lítio, Alumínio, Fósforo, Enxofre e Xenônio, são exemplo de elementos que não respeitam a regra. Esses elementos podem sofrer uma expansão ou contração da última camada de valência, se tornando estáveis com maior ou menor número de elétrons.
Há ainda o Hidrogênio e Hélio, que respondem à Regra do Dueto, onde suas camadas suportam no máximo dois elétrons. Para muitas regras, muitas exceções.
A Teoria do Octeto foi proposta por Gilbert Newton Lewis (1875-1946), um químico e físico americano que observou as interações entre diversos compostos químicos. Ele é mais conhecido por sua contribuição no entendimento sobre ácidos e bases.

Ele observou que os elementos atingiam estabilidade após completarem oito elétrons em sua camada de valência, assim como ocorre na configuração natural dos gases nobres. O grupo 18 da Tabela periódica é conhecido por sua estabilidade e baixa reatividade com outros elementos.
Mas como outros elementos, com menor número de elétrons na última camada de valência, podem atingir esse patamar de estabilidade? Através das ligações químicas! Bora brincar de especulação eletrônica.
Estou ligando porque o grande amor da minha vida é a química
Existem alguns tipos de ligações químicas, mas hoje vamos focar, principalmente, em duas: Ligações Covalentes e Ligações Iônicas. Elas apresentam propriedades diferentes e ligam elementos diferentes. Então, fique ligado.
Ligação Covalente
Esse tipo de ligação ocorre principalmente entre elementos não metálicos, através do compartilhamento de elétrons. Em um exemplo, simples, é se irmãos estivessem compartilhando o mesmo guarda-roupa.
Nesse tipo de ligação não há alteração na distribuição eletrônica dos elementos, além disso, os átomos a serem ligados apresentam o mesmo grau de eletronegatividade.
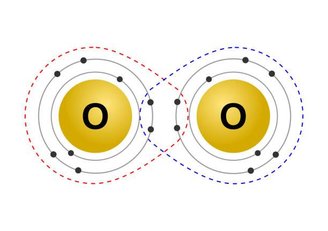
As ligações químicas do tipo covalente ainda podem ser classificadas como simples, quando há o compartilhamento de apenas um par de elétrons, duplas, como na imagem acima, quando há o compartilhamento de dois pares e triplas, quando há compartilhamento de três pares de elétrons.
Os compostos formados por ligações covalentes nem sempre serão solúveis em água, e geralmente, são maus condutores de eletricidade, exceto pelo grafite. Também podem ser maleáveis e relativamente resistentes, e que nesse ponto, ganha em força das ligações iônicas. E falando nela.
Ligações Iônicas
A principal característica das ligações iônicas está na doação de elétrons entre elementos metálicos e não metálicos. Nesse tipo de ligação química há uma mudança na distribuição eletrônica dos elementos, pois doar uma ou mais cargas eletricamente negativas, gera uma alteração no nível de distribuição eletrônica do elemento, assim como uma alteração na polaridade das moléculas.
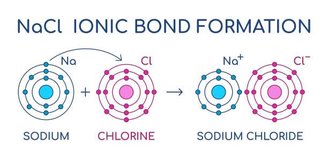
Isso implica em uma ligação entre átomos com diferentes graus de eletronegatividade. Após a doação, essa diferença irá se manter, e a força de ligação entre esses elementos está exatamente na atração que essas diferenças provocam.
Quem doa não fica sem, mas sim, estável. Se lembrarmos das distribuições eletrônicas pelo Diagrama de Linus Paulling, sabemos que os elétrons estão em diferentes níveis, e cada nível pode ser alterado pelas doações ou recepções entre as interações dos elementos. Se um elemento fornece uma partícula, é porque estava disponível.
Outros fatores interessantes sobre os compostos de ligações iônicas é sua solubilidade em água, alta condutividade, devido ao movimento dos elétrons e altos pontos de fusão e ebulição devido à forte atração entre os íons.

Compostos iônicos formam redes cristalinas tridimensionais, onde os íons são mantidos unidos por forças eletrostáticas. Contudo, essas estruturas podem ser um pouco frágeis. Além da solubilidade em água, forças externas podem “obrigar” que os átomos sofram um rearranjo, que pode acarretar interações entre íons de igual polaridade e polos iguais se repelem. Foi forte enquanto durou.
Qual ligação química é mais forte?
Já posso ver a expectativa em seus olhos para saber o resultado do duelo de hoje, porém, como sempre, a resposta é um grande: depende! Quando falamos de força e ligações químicas, precisamos pensar em quais aspectos de força estamos falando.
Em relação à forma de ligação entre um átomo e outro, as ligações iônicas ganham em disparada devido às reações que a doação de elétrons geram formando uma força de ligação através da diferença de polaridade entre as moléculas, dentre outros fatores.

Sendo assim, as ligações químicas do tipo covalente também têm seu espaço, sendo fortes e resistindo à solubilidade e sendo bastante estáveis. Além disso, compostos formados por esse tipo são maleáveis e adaptáveis, e vimos acima que cristais de ligações iônicas podem se um pouco frágeis.
Nesse embate, a vencedora irá depender da característica analisada, mas o que pode ser afirmado sem dúvidas é que nosso mundo só se mantém coeso e funcional graças a essas interações maravilhosas, complexas e diversas.
Sendo você o jurado, para quem você daria o prêmio de ligação química mais forte? Nos conte em nossas redes sociais e enquanto decide, talvez queira incluir a ligação de carbono no páreo para inflamar essa disputa entre as ligações químicas!
Eu sei que tem uma química entre você e a TecMundo, então mantenha a ligação acompanhando nossos conteúdos. Até mais!

