Todos os dias, incontáveis átomos, do Nitrogênio, o sétimo elemento da Tabela Periódica, representado pela letra ‘N’ e de massa atômica 14u, passam por um ciclo de biodisponibilização que oportuniza o mundo que vivemos.
Do crescimento das plantas e estruturação do nosso DNA até matéria-prima para diversão e carros velozes, o Nitrogênio sem dúvidas é um dos elementos mais versáteis conhecidos.
Em algumas ocasiões ele pode apresentar um comportamento dual, sendo extremamente necessário para manutenção da vida, porém, pode ser potencialmente fatal em quadros de intoxicação ocasionados pela ingestão de água ou comida contaminada.
Extremamente abundante, ao mesmo tempo que pouco disponível, venha conhecer usos e um pouco da história do elemento Nitrogênio.

Do céu ao solo: Nitrogênio
O Nitrogênio é o quinto elemento mais abundante no Universo e compõe, em volume, 78% dos gases da nossa atmosfera. No ar, ele é encontrado na forma de N2, onde duas moléculas do elemento se unem por uma ligação tripla muito resistente. É um gás inodoro, incolor e não tóxico.
Ele foi descoberto em meados de 1760 por Henry Cavendish e Joseph Priestley, após a queima do Oxigênio. Porém, eles não consideram que aquele gás capaz de matar ratinhos indefesos e apagar velas fosse um novo elemento.
Sua descrição então foi deixada de lado e retomada por Daniel Rutherford em 1772, que foi capaz de isolar o elemento. O nome foi sugerido por Jean-Antoine Claude Chaptal, em 1790, unindo as palavras gregas ‘nitron’ e ‘gene’, que seria algo como produtor de salitre. Sim, o mesmo ‘sal’ que você conhece, e provavelmente não gosta.

Com o passar dos anos, os cientistas passaram a analisar onde e em que combinações o Nitrogênio aparecia na natureza. Eles perceberam que o elemento estava presente em boa parte do universo, cumprindo papéis essenciais. Quando falamos em DNA e RNA, por exemplo, toda a cadeia é formada pelas bases nitrogenadas, Guanina, Adenina, Uracila, Timina e Citosina.
Nosso corpo não produz Nitrogênio, então precisa obtê-lo a partir da alimentação para manter todas as estruturas e funções celulares em ordem. Mas o sétimo elemento não é tão biodisponível como parece.
Sua forma gasosa N2 não pode ser metabolizada pelas plantas, principal fonte de hidrogênio para animais e seres humanos. Para que ele possa ser utilizado, precisa passar por uma transformação, dando início ao que conhecemos como Ciclo do Nitrogênio.
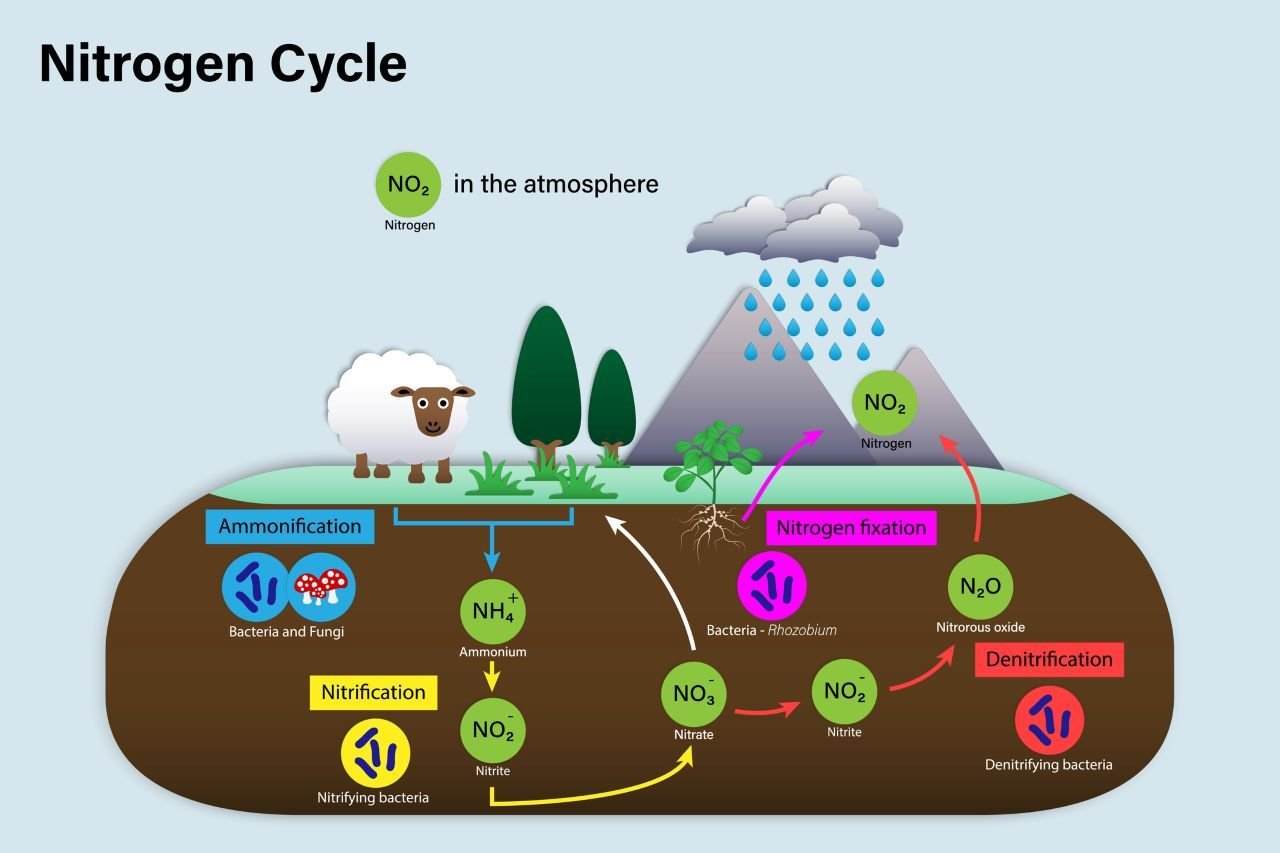
O ciclo conta com algumas etapas, como a Fixação do Nitrogênio, onde bactérias especializadas presentes nas raízes das plantas captam e convertem o N2 em uma forma biodisponível através da ligação da molécula do elemento com Hidrogênio, formando amônia, que irá contribuir para o crescimento e fortalecimento das plantas.
Não por acaso, a indústria agrícola aprendeu a reproduzir esse efeito de forma artificial para a produção de fertilizantes à base de nitrogênio, garantindo maior eficiência das lavouras. Nesse caso, o processo é chamado de Síntese Harber-Bosch.
Naturalmente ainda há outros processos, como a Nitrificação, que transforma a amônia em Nitrito e posteriormente em nitrato e o caminho inverso, transformando esses compostos novamente em Nitrogênio gasoso, através da desnitrificação.
Todo esse processo contribui para que sempre tenhamos quantidades adequadas de Nitrogênio circulante e disponível para manutenção das estruturas celulares de plantas, animais e humanos.
No organismo, o elemento contribui para o equilíbrio na síntese de proteínas, sinalização hormonal, regulação no ciclo da ureia, dentre outras funções. Quando morremos, o Nitrogênio presente nos nossos tecidos volta para o solo em um processo de amonificação.
O arroz de festa da Tabela Periódica
Acima nós demos uma pincelada sobre a potencialidade da utilização do Nitrogênio e seus compostos na indústria de alimentos, seja através da produção de fertilizantes ou no preparo de alimentos.
No caso dos implementos agrícolas, o excesso de uso de fertilizantes nitrogenados pode contribuir para a contaminação dos solos e nascentes, interferindo não apenas no ciclo natural, que se torna saturado e incapaz de sintetizar todos os compostos disponíveis, mas contribuindo para intoxicação humana.
Ainda que sua forma gasosa não seja tóxica, os nitritos e nitratos possuem potencial para causar intoxicação e saturação das hemoglobinas, diminuindo o transporte de oxigênio, causando condições de hipóxia e anóxia.

?O mesmo tipo de condição pode ocorrer na criação de gado, quando os animais são alimentados com pastagem saturada em nitrito ou nitrato, proveniente da adubação incorreta.
Quando utilizados como conservantes em embutidos e alimentos ultraprocessados, podem ser indutores de carcinogênese, ligado também a malformações fetais, decorrentes de altos níveis de nitrato no sangue materno.
Mas os usos industriais vão além. Em sua forma gasosa, o nitrogênio é responsável pelo famoso “gás hilariante”, assim como o ‘nitro’ dos carros de corrida, e se aventuras em solo não são suficientes para você, que tal um mergulho?

Os cilindros de mergulho são preparados com uma ‘mistura’ chamada de Nitrox, onde Nitrogênio e Oxigênio são misturados em proporções próximas ao ar ambiente, potencializando a capacidade de pressurização dos cilindros e minimizando as chances da doença descompressiva, causada pelo retorno rápido à superfície.
Como seu ponto de fusão é próximo ao zero Kelvin, ele é muito utilizado em pesquisas com super ímãs e criogenia. Há inclusive um estudo brasileiro recente que através da crioablação, pela primeira vez, foi capaz de extinguir células do câncer de mama. Viva o Nitrogênio!
Esse elemento sem dúvidas possui diversos usos e funcionalidades e não à toa, ele é um dos CHONPS, considerados os elementos essenciais para existência e manutenção da vida no universo.
Ainda que ele sozinho não seja capaz de suportar a vida, e por isso, Antoine Lavoisier o que chamar de Azoto, quem sabe em algum outro lugar do cosmos, ao invés de Carbono, não haja uma vida baseada em Nitrogênio?
Enquanto você se pergunta se isso é possível e não um delírio febril, que tal descobrir se dá para fazer uma salada de frutas com todos os elementos da Tabela Periódica? Continue acompanhando o TecMundo e não perca os próximos elementos! Te vejo em breve.

